En savoir plus sur le MDR1 (la sensibilité médicamenteuse) chez le chien.
Le gène MDR1 (ou aussi ABCB1) chez le chien
. Certains chiens ont une mutation de leur gène MDR-1. Ce gène sert à fabriquer une protéine (la glycoprotéine P ou P-gp), qui expulse du cerveau certains médicaments qui auraient tendance à s'y accumuler en trop grande quantité, provoquant une intoxication.
. Les races les plus prédisposées à la mutation du gène MDR-1 sont les colleys, shetlands, bergers australiens, bergers blancs suisses, bobtails, et à un degré moindre les border collies.
. Les médicaments qui posent le plus de problèmes chez les chiens à gène MDR-1 muté sont les antiparasitaires de la famille des lactones macrocycliques (ivermectine, milbémycine, moxidectine…) ainsi que le spinosad et l'émodepside, des antidiarrhéiques ou antivomitifs (lopéramide, métoclopramide, dompéridone), des antibactériens (spiramycine, métronidazole…), des sédatifs (acépromazine, butorphanol…), et des produits de chimiothérapie. Entre autres.
. Il est fortement conseillé aux propriétaires de chiens appartenant à une race à risque, de faire tester leur animal, afin de savoir s'il est porteur du gène MDR-1 muté. Ceci afin de savoir exactement quels médicaments donner ou ne pas donner au chien.
(Cliquez sur l'image pour l'agrandir)
LE GÈNE MDR1, COMMENT çA MARCHE ?
Vraiment pas de quoi être mort de rire : MDR signifie Multidrug Resistance Gene, mais quand on veut être moderne, on parle de gène ABCB1, son nouveau nom depuis quelques années, puisque tout change tout le temps, et que ça n’est pas près de s’arrêter. On va essayer d’en parler sans être trop trop technique pour autant, allons-y.
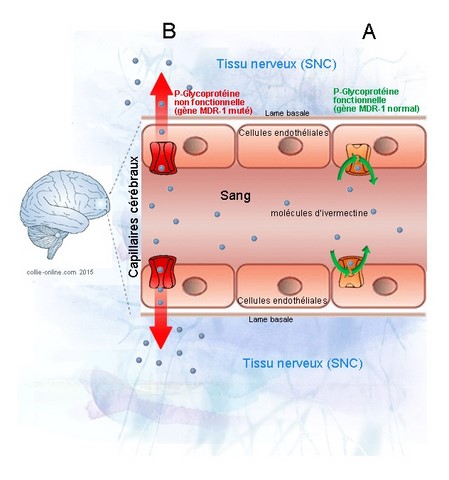
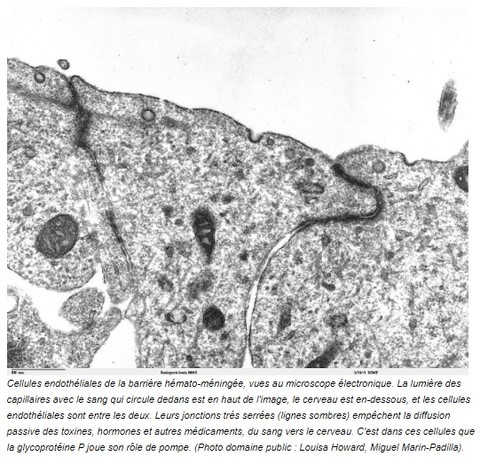
Donc, le gène MDR1 permet la synthèse d’une protéine, appelée glycoprotéine P, ou P-gp. Cette protéine se situe dans les cellules endothéliales qui constituent la barrière hémato-méningée. Dit comme ça, ça fait peur, mais pas de panique.
Imaginez le cerveau, qui baigne dans son liquide cérébro-spinal. Autour, il y a plein de petits vaisseaux sanguins (les capillaires). Entre les deux, il y une barrière. Pourquoi une barrière, me direz-vous ? Parce que sans barrière, tout ce qui circule dans le sang passerait dans le cerveau. Et dans le sang, il y a des nutriments dont le cerveau a besoin, mais il y a aussi des bactéries, des virus, des toxines, des hormones, des médicaments… et si tout ça passait sans contrôle du sang au cerveau, ça poserait vite des problèmes.
Donc, il y a une barrière entre le sang et le cerveau. Celle-ci est constituée par les cellules endothéliales (photo ci-dessus, cliquez dessus pour l'agrandir), qui se trouvent dans la paroi des petits vaisseaux sanguins (les capillaires). Comme les jonctions entre ces cellules endothéliales sont très serrées, rien ne transite sans contrôle à travers elles : tout ce qui passe dans un sens ou dans l’autre entre sang et cerveau fait l’objet d’un filtrage ou d’un transport actif, à l’intérieur des cellules endothéliales. Les aliments rentrent, les déchets sortent, mais toxines et bactéries, (du moins la plupart d’entre elles), sont priées de rester à la porte. Et c’est dans ce transport actif à l’intérieur des cellules endothéliales, qu’intervient la glycoprotéine P, ou P-gp : il s’agit d’une pompe de reflux, qui prend les médicaments qui s’accumulent dans le cerveau, et les expulse dans le sang. (Sans trop vouloir compliquer les choses, ajoutons qu’on la trouve aussi au niveau de l’intestin, des reins et du foie, où elle joue un peu le même rôle d’élimination des médicaments). Vous êtes toujours là ? alors, on continue.
On revient à notre gène MDR1. On rappelle que c’est lui qui code pour la fabrication de la glycoprotéine P dont on vient de parler. Evidemment, si le gène MDR1 est abîmé, il va faire synthétiser une glycoprotéine P anormale, qui ne sait plus pomper. Si la glycoprotéine P ne pompe plus, les médicaments qu’elle refoulait du cerveau vers le sang ne sont plus refoulés, et s’accumulent dans le cerveau. Du coup, si on donne à un chien portant le gène MDR1 muté, un médicament normalement expulsé par la P-gp, ce médicament, même administré à dose normale, se retrouve en quantité monstrueuse dans le cerveau du chien. Exactement comme si l’on administrait ce même médicament à une dose beaucoup trop forte, à un chien « normal ». Dans les deux cas, le cerveau se montre affecté de ce surdosage de médicament, et arrête de fonctionner normalement : on parle de neurotoxicité.
Et comme si cela ne suffisait pas, non seulement la glycoprotéine anormale ne pompe plus les médicaments concernés hors du cerveau, mais elle les élimine aussi moins bien par les reins, et les absorbe davantage par l’intestin !
Et comme si cela ne suffisait encore pas, un certain nombre de médicaments bloquent l’action de la P-gp, ce qui lui fera une raison de plus de moins pomper. (On y revient un peu plus loin, avec des exemples des médicaments en question).
Vous avez tenu bon jusqu'à maintenant ? Allez, encore un dernier effort pour un petit point de génétique, et on pourra en revenir à des considérations plus terre à terre – mais vous verrez que tout ce qu’on a appris jusque là aidera à comprendre la suite.
Vous savez peut-être que tous nos gènes sont présents en deux exemplaires dans chacune de nos petites cellules, portés par deux brins d'ADN qui se font face sous forme d'une double hélice. Si l’un des deux exemplaires est défaillant, parfois le deuxième exemplaire peut compenser les carences du premier… mais parfois pas. Dans le cas de la mutation sur le gène MDR1, on est entre les deux ! Si un chien est porteur de deux gènes MDR1 normaux (on parle aussi d'homozygote non muté +/+), tout va bien : sa petite pompe P-gp fonctionnera à plein régime, le chien pourra prendre les médicaments concernés sans que ceux-ci ne s'accumulent à l'intérieur de son cerveau. S’il est porteur de deux gènes mutés, (on parle d’homozygote muté -/-), sa petite pompe ne fonctionnera pas du tout, et il risquera d’avoir des problèmes. S’il est hétérozygote +/-, sa petite pompe marchera à 50 % de ses capacités. Son risque d’intoxication sera donc moindre que pour un homozygote muté -/-, (symptômes moins marqués, et pour des doses plus élevées de médicament), mais pas nul.
Accessoirement, un chien homozygote muté -/- transmettra forcément un gène muté (-) à tous ses descendants, alors que les descendants d’un hétérozygote +/- auront une chance sur deux de récupérer un gène normal (+) et une chance sur deux de récupérer le gène muté (-). L’homozygote normal +/+ transmettra évidemment un gène normal (+) à tous ses chiots.
Dernier point, qui prouve s’il en était encore besoin que la vie est décidément bien mal faite, et que les choses sont toujours plus compliquées qu’on ne le voudrait : on a trouvé récemment le même genre de sensibilité médicamenteuse chez un Border collie non porteur de la mutation du gène MDR1. Comme quoi, une mutation sur d’autres gènes peut conduire au même résultat, et ce n’est pas parce qu’un chien n’est pas porteur de la mutation sur ce gène que l’on peut être sûr qu’il ne présentera pas de neurotoxicité lors de la prise de médicament. Cela dit, ce cas de figure ne se présente tout de même pas souvent, Dieu merci.
QUELS SONT LES CHIENS CONCERNÉS ?
Les races de chiens (ou de chats, de vaches, de cochons, de poules…), sont issues d’une sélection fondée sur des critères de beauté, de travail, de comportement, etc. Quand un individu, ou un petit groupe d’individus, présentait les caractères recherchés, les éleveurs des siècles passés les ont abondamment croisés et recroisés entre eux, afin d’obtenir un groupe homogène d’animaux présentant les caractéristiques désirées. On a ainsi obtenu de très jolis chiens de compagnie, ou d’excellents chiens de chasse, de garde, de troupeau, etc. Le problème, c’est que si l’un des ancêtres de la race présentait une prédisposition génétique à telle ou telle maladie, celle-ci s’est répandue dans la race en question, en même temps que les qualités génétiques recherchées. Voilà pourquoi la mutation du gène MDR1 s’est retrouvée, sinon exclusivement, du moins de façon très préférentielle dans certaines races. Comme les choses ne sont jamais simples, des variations existent d’un pays à l’autre et d’une étude à l’autre, mais de fortes tendances se dégagent tout de même.
Parmi les races à risque, selon un document publié par le laboratoire Antagène et concernant la population française, on trouve loin devant le Colley (85 % de chiens porteurs du gène, dont une moitié environ d’homozygotes -/-), le Berger australien et le Shetland, quasiment à égalité avec respectivement 54 et 52 % de chiens porteurs dont 10 % d’homozygotes mutés, le Berger blanc suisse (26 % dont 1 % seulement de -/-), le Bobtail (7 %) et le Border collie (3 %). Bouvier australien, Whippets et Bergers allemands peuvent aussi être porteurs du gène. Ces pourcentages varient fortement en fonction des études et des pays : des données plus récentes concernant le Berger blanc suisse le mettraient ainsi à 57 % de chiens porteurs, tandis qu’une étude allemande le situe à 14 %.
Une étude américaine de 2008 portant sur 5368 chiens place en tête de liste les Colleys (35 % d’homozygotes mutés et 42 % d’hétérozygotes, sur 1424 testés), et les Bergers australiens (10 % d’homozygotes mutés et 37 % d’hétérozygotes, sur 1421 testés). La mutation était également assez fréquente chez les Shetlands (12 %) et les Bergers allemands (10 %), ainsi que chez des races plus confidentielles, tout au moins dans nos contrées (Whippet à poils longs, Berger australien miniature, Silken Windhound). Les Border collies étaient très peu représentés, avec 1 % d’hétérozygotes seulement. Remarquons que sur 238 chiens « croisés » testés, 11 % étaient porteurs, dont 3 % homozygotes mutés -/-.
Une étude brésilienne de 2014 portant sur un nombre plus réduit de chiens donne des résultats comparables, avec un net « avantage » aux Colleys, Bergers australiens et Shetlands, mais un pourcentage significatifs de Bobtails, Whippets, Bergers allemands et Border collies porteurs de la mutation.
Plus près de nous géographiquement, une étude allemande de 2011 portant sur 7378 chiens, place en tête de liste sans surprise le Colley (59 % porteurs du gène mutant), les Whippets à poils longs (45 %), Shetlands (30 %), Bergers australiens (miniatures ou pas : 24-22 %), Bergers blancs suisses (14 %), Bobtails (4 %), et Border collies (1 % seulement). Notons que 10 % des chiens « de travail » et « croisés » de cette étude étaient porteurs de la mutation.
À quelques variations géographiques près, et en excluant les races que l’on ne rencontre jamais, on peut donc dire que Colleys, Bergers australiens, Shetlands, et à un degré moindre Bergers blancs suisses, sont les grands « vainqueurs » de ce classement. Bien que moins représentés, Bergers allemands et Bobtails ne doivent pas être négligés. Il en est de même des Border collies, que l’on aurait pu malgré tout s’attendre à voir figurer en « meilleure » position sur cette échelle de risque. Et n’oublions pas non plus les croisements de ces différentes races ! Méfiance devant un chien de parents inconnus, mais à la robe merle, fréquente chez les Bergers australiens, ou à la toison frisée évocatrice d’un Bobtail…
Enfin, n’oublions pas que d’autres gènes mutés peuvent conduire aux mêmes intolérances médicamenteuses ! Comme nous l’avons vu plus haut, un Border collie homozygote non muté pour le MDR1, peut avoir une glycoprotéine P déficiente à cause d’une mutation sur un autre gène. Bon, ça existe, c’est décrit, mais ce n’est quand même pas bien fréquent.
Autre cas de figure rare, mais qui existe, en dehors de toute prédisposition raciale, n’importe quel chien peut accidentellement subir une mutation : il se fabrique alors tout seul, comme un grand, son gène MDR1 muté, sans avoir eu besoin de l’hériter de ses parents.
Enfin, signalons que les animaux âgés sont plus exposés à ce type d’accident médicamenteux, car la glycoprotéine P présente dans les reins fonctionne de moins en moins bien avec l’âge, et comme c’est elle qui évacue le médicament par les reins… eh bien le médicament a tendance à taper l'incruste dans l’organisme du chien !
QUELS SONT LES MÉDICAMENTS CONCERNÉS ?
1 – La (les) listes :
Alors, la liste et longue, et les médicaments variés !
Au point qu’à la lecture des listes les plus complètes, on se demande ce qu’on peut encore administrer à un chien appartenant à une race à risque.
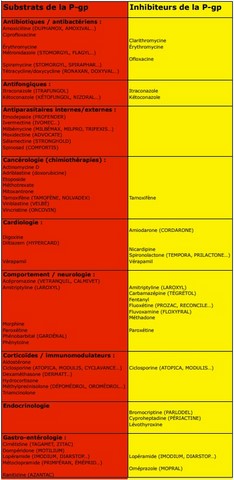
Deux catégories de molécules sont concernées. D’abord, il y a celles qui sont normalement pompées hors du cerveau par la glycoprotéine P, et qui s’accumulent dans le cerveau des chiens mutés : on parle de substrats de la P-gp. D’autres molécules inhibent la P-gp. Enfin, certains médicaments poussent le vice jusqu’à être à la fois substrats et inhibiteurs ! Il faudra donc se méfier tout particulièrement de ces derniers, mais aussi éviter de mélanger un substrat et un inhibiteur sur une même ordonnance, chez un chien à risque !
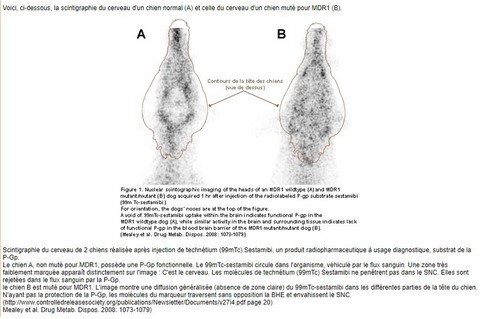
Le médicament le plus connu et le plus étudié, parmi ceux qui posent des problèmes aux chiens ayant la mutation MDR1, est l’ivermectine. Cette molécule est surtout commercialisée comme antiparasitaire pour les grands animaux, mais elle est parfois utilisée chez le chien, du fait de son intérêt pour traiter certains parasites, et de son faible coût. Il arrive aussi qu’un chien (ou un chat) arrive à s’emparer d’un tube d’ivermectine destiné aux chevaux ou aux ruminants, et à le consommer. Ce qui fait évidemment un gros surdosage, a fortiori si le chien est un Colley avec une glycoprotéine P déficiente, incapable de pomper hors du cerveau l’ivermectine surdosée.
Un tableau un peu plus synthétique, où les médicaments sont regroupés en fonction de leur usage, avec la distinction entre substrats et inhibiteurs, est reproduit ci-dessus. Nous avons indiqué les noms des molécules, et quelques-uns des noms de médicaments correspondants les plus connus (liste non exhaustive). (Et si vous cliquez sur le tableau, il s'affiche en gros !)
Enfin, une sélection restreinte, qui a l’avantage de mettre clairement en évidence les molécules les plus dangereuses, est publiée sur le site Antagène :
- Molécules à proscrire : ivermectine, lopéramide, emodepside, doramectine, abamectine.
- Molécules à éviter : milbémycine, moxidectine, spiramycine,
- Molécules avec précautions obligatoires : métoclopramide, métronidazole, spinosad,
- Molécules avec précautions à prévoir : acépromazide, butorphanol, vincristine, vinblastine, doxorubicine, dompéridone.
Signalons enfin aux adeptes des cinq fruits et légumes par jour, qui veulent en faire profiter leur chien, que le jus d’orange, le jus de raisin et le jus de pamplemousse font partie des inhibiteurs de la P-gp.
2 – Le cas particulier des antiparasitaires :
Il me semble intéressant de dire un mot d’antiparasitaires parmi les plus utilisés, et potentiellement toxiques pour les chiens appartenant aux races prédisposées. Il y a évidemment plus de risque qu’un Colley avale un de ces antiparasitaires très répandus, qu’un médicament de chimiothérapie, par exemple. Il est donc intéressant de savoir ce qui est officiellement recommandé ou pas pour chacun d’eux. Cinq molécules sont concernées. Trois appartiennent au groupe des lactones macrocycliques (LM), comme l’ivermectine déjà citée. Les deux autres sont le spinosad et l’emodepside. Ce sera peut-être un peu touffu, mais bon. Si c’est vraiment too much, vous pouvez zapper.
- La milbémycine oxime :
C'est un antiparasitaire interne actif contre les vers ronds, et également utilisé pour la prévention de la dirofilariose. Cette molécule entre dans la composition d’antiparasistaires très populaires, seule (INTERCEPTOR), en association avec le praziquantel qui touche les vers plats (MILBÉMAX, MILPRO, MILPRAZON…), ou plus récemment avec l’afoxolaner, très actif sur les puces et les tiques (NEXGARD SPECTRA). L’association milbémycine-spinosad (TRIFEXIS) sera traitée un peu plus loin. Tous ces médicaments se présentent sous la forme de comprimés, le plus souvent appétents.
Le résumé des caractéristiques du produit (RCP) des médicaments à base de milbémycine seule, ou associant milbémycine et praziquantel, indique que la marge de sécurité est plus basse chez certains chiens de race Colley et apparentés, et que pour ces animaux, la posologie de 0,5 mg/kg doit être strictement respectée. Pour la milbémycine seule, l'administration mensuelle à la posologie recommandée n'a entraîné aucune réaction d'intolérance chez plus de 75 races de chiens, Colley compris. Il est précisé que la tolérance du produit chez les jeunes chiots de ces races n’a pas été étudiée. Pour l’association milbémycine-afoxolaner, il est seulement indiqué que la dose recommandée doit être strictement respectée chez les Colleys ou les races apparentées.
Selon leur RCP, les médicaments à base de milbémycine, ou associant milbémycine et praziquantel n’interagissent pas avec une autre lactone macrocyclique, la sélamectine (STRONGHOLD), et leur administration concomitante est bien tolérée, lorsque tous ces médicaments sont administrés à la dose recommandée. En revanche, en l’absence d’autres études, « une attention particulière doit être prise en cas d’administration concomitante de ce médicament avec d’autres LM ».
En ce qui concerne l’association milbémycine-afoxolaner, il est indiqué qu’un traitement concomitant avec d’autres substrats de la P-gp (y compris d’autres LM), peut augmenter la toxicité.
- La sélamectine :
C'est un antiparasitaire essentiellement utilisé pour son action anti-puces, mais également indiqué en prévention de la dirofilariose, et en traitement d’un certain nombre de parasites externes et internes. Elle se présente sous forme de pipettes, à vider sur la peau du chien (spot-on).
Selon sa RCP, le STRONGHOLD a été testé sans signe clinique indésirable chez des chiens appartenant à plus de cent races pures et croisées différentes, y compris chez des chiens de race Colley, et administrée à 5 fois la dose recommandée à des Colleys sensibles à l’ivermectine, sans qu’apparaissent des effets indésirables.
Concernant les associations, aucune incompatibilité n’est rapportée entre STRONGHOLD et « les médicaments vétérinaires d’usage courant ».
- La moxidectine :
C'est une autre LM, de la même famille que la milbémycine, active contre de nombreux parasites externes et internes. On la trouve associée à l’imidacloprid (ADVOCATE), sous forme de pipettes, à vider sur la peau du chien (spot-on).
La RCP de l’ADVOCATE indique que des précautions devront être prises avec les Colleys, les Bobtails et les races apparentées ou croisées, afin d’administrer correctement le produit. En particulier, celui-ci ne devra pas être avalé. Les Colleys sensibles à l’ivermectine ont toléré jusqu’à 5 fois la dose recommandée répétée à des intervalles d’un mois, sans aucun effet indésirable, mais la sécurité de l’application à des intervalles d’une semaine n’a pas été étudiée chez ces Colleys.
Une autre LM ne doit pas être administrée pendant le traitement par ADVOCATE.
La moxidectine existe aussi sous forme de pâtes ou de liquides à avaler, pour les grands animaux (chevaux ou ruminants). Un chien qui tomberait sur l’une de ces présentations et s’en régalerait serait déjà exposé à un sérieux surdosage, a fortiori s’il s’agissait d’un chien porteur de la mutation du gène MDR1. Donc, prudence si vous avez ce genre de produit dans la pharmacie familiale. (Ou dans la pharmacie de l’écurie, d’ailleurs).
Signalons que la moxidectine est le principe actif de la CYDECTINE, vermifuge en solution orale pour ovins qui constitue actuellement l’un des traitements, voire LE traitement de référence de la démodécie généralisée du chien. Alors évidemment, attention à la dose, et prudence prudence avec les races à risques.
- Le spinosad :
Antiparasitaire externe en comprimés, il est efficace pour le traitement et la prévention de l’infestation par les puces (COMFORTIS).
Il s’agit d’un substrat de la P-gp mais curieusement, la RCP du COMFORTIS ne fait pas état de précautions particulières) à prendre vis à vis des Colleys ou races apparentées.
Le RCP mentionne dans les Interactions médicamenteuses qu’en tant que substrat de la P-gp, le spinosad est susceptible d’interagir avec d’autres substrats (par exemple digoxine ou doxorubicine), et pourrait potentialiser les effets indésirables de ces molécules, ou compromettre leur efficacité.
Les rapports post-commercialisation, suite à l’utilisation concomitante hors-AMM de doses élevées d’ivermectine et de Comfortis, ont fait état de tremblements/secousses musculaires, salivation/hypersyalie, convulsions, ataxie, mydriase, cécité et désorientation chez les chiens.
Le spinosad est aussi utilisé en association avec la milbémycine (TRIFEXIS) sous forme de comprimés, pour le traitement et la prévention de l’infestation par les puces, la prévention de la dirofilariose, et le traitement de l’infestation par les vers ronds. Nous avons donc là l’association de deux substrats de la P-gp.
La RCP indique que l’innocuité de ce médicament chez les chiens sensibles à l’ivermectine/les chiens présentant une mutation du gène MDR-1 n’a pas été suffisamment démontrée. Ces chiens peuvent être exposés à un risque plus élevé d’effets indésirables s’ils sont traités avec ce médicament, et doivent donc être traités avec une prudence accrue.
Le RCP du TRIFEXIS indique que le spinosad et la mylbémycine oxime sont des substrats de la P-gp et peuvent donc interagir avec d’autres substrats (par exemple digoxine ou doxorubicine), ou d’autres LM. Par conséquent, le traitement concomitant avec d’autres substrats de la P-gp peut augmenter la toxicité.
Les rapports post-commercialisation, suite à l’utilisation concomitante du spinosad et de l’ivermectine, ont fait état de tremblements/secousses musculaires, salivation/hypersyalie, convulsions, ataxie, mydriase, cécité et désorientation chez les chiens.
- L’émodepside :
C'est un antiparasitaire actif sur les vers ronds, que l’on trouve associé au praziquantel sous forme de comprimés (PROFENDER).
Après utilisation, des troubles neurologiques transitoires et légers (tremblements, incoordination), ont été observés dans de très rares cas selon le RCP, qui précise que ces signes neurologiques peuvent être plus sévères (convulsions) chez les Colleys, Shetlands et Bergers australiens mutants pour MDR1 (-/-). Chez les Colleys mutants, la marge de sécurité semble moins importante comparée au reste de la population canine, avec des tremblements modérés et transitoires et/ou de l’ataxie occasionnellement observés après administration de deux fois la dose recommandée (vs cinq fois dans le reste de la population).
Pour ce qui est des interactions médicamenteuses, des traitements simultanés avec d’autres substrats/inhibiteurs de la P-gp (ivermectine et autres LM, érythromycine, prednisolone, ciclosporine…), pourraient conduire à des interactions sur la pharmacocinétique de ces médicaments. Les conséquences cliniques potentielles de telles interactions n’ont pas été évaluées.
Cliquez ici pour avoir un listing un peu plus complet des molécules à risque
ALORS, GÈNE + MÉDICAMENT = signes cliniques
L’ivermectine et les autres lactones macrocytaires qui ne sont plus pompées hors du cerveau et s’y accumulent, provoquent des symptômes… neurologiques. On observera donc, en vrac, une prostration, une ataxie (incoordination des mouvements), une hypersalivation, des tremblements voire des convulsions, une bradycardie (ralentissement du cœur), une mydriase (dilatation des pupilles), et parfois une cécité. Celle-ci apparaît de quelques jours à quelques semaines après le traitement, et peut être réversible (souvent en 12-24 heures, mais parfois après trois semaines)… ou pas. Dans les cas les plus grave, l’intoxication évolue vers une dépression respiratoire, le coma, et la mort.
Avec d’autres substrats, les symptômes peuvent être moins axés sur le système nerveux, et plus en rapport avec le médicament à l’origine de l’intoxication : symptômes digestifs, cardiaques, etc. C'est le cas, par exemple, avec les produits de chimiothérapie, en particulier la vincristine. L'administration de cette dernière a un chien porteur du gène MDR1 muté va provoquer une neutropénie majeure (effondrement du nombre des polynucléaires neutrophiles, globules blancs très sensibles à la vincristine), ainsi que des symptômes digestifs sévères .
Evidemment, plus important sera le surdosage, plus marqués seront les symptômes. Donc, un chien homozygote muté pesant 10 kg, qui avale un plein tube de vermifuge pour chevaux, sera globalement plus mal parti qu’un berger blanc suisse de 35 kg hétérozygote, qui aura juste consommé un médicament à risque, à sa dose normale.
NB : Il faut savoir quand même que les médicaments enregistrés en Belgique sont testés "OK" pour le MDR -/- sauf dans de très rares cas où c'est explicitement inscrits dans la notice.
ET çA SE SOIGNE ?
Donc si le chien vient d’avaler le produit (depuis moins d’1/2 heure, au pire une heure), et s’il ne présente pas encore de troubles nerveux (tremblements, convulsions…) qui pourraient provoquer une fausse déglutition, on le fait vomir. (Votre vétérinaire aura une injection pour cela). Si ça fait plus d’une heure, le médicament est déjà sorti de l’estomac, et faire vomir le chien ne servira plus à rien : on fait alors avaler du charbon activé, qui favorise l’élimination par l’autre extrémité du tube digestif.
Les chiens intoxiqués par voie externe (antiparasitaires en pipette), sont lavés énergiquement, et le plus tôt sera le mieux.
2 – Traitement de soutien :
Rien de spécifique, mais c’est essentiel pour tenir bon en attendant que ça passe - ce qui peut prendre un jour, trois jours, ou plusieurs semaines : on perfuse, on réchauffe, on lutte contre les escarres si le chien est inconscient, on essaye d’arrêter les convulsions s'il y en a. On traite les symptômes au fur et à mesure qu'ils apparaissent : par exemple, avec des antivomitifs et des protecteurs de l'estomac, en cas de troubles digestifs. Si besoin est, on met sous oxygène, on nourrit par sonde, on soutient le cœur… Dit comme ça, ça a l’air simple, mais maintenir un chien sous respiration assistée pendant trois semaines posera des problèmes de logistique insurmontables à la plupart des structures vétérinaires.
3 – Traitement spécifique :
On ne peut pas réellement parler de traitement spécifique, mais on sait depuis peu qu’on améliore le pronostic, et qu’on accélère considérablement la récupération des chiens empoisonnés par les lactones macrocycliques, en leur passant une perfusion d’émulsions lipidiques intraveineuses. Dit plus simplement, les lactones macrocycliques sont des produits solubles dans les graisses, donc on met de la graisse dans le sang. Les LM quittent alors le cerveau qu’elles intoxiquaient, et se coulent avec délice dans le sang bien gras, avant d’être éliminées. Pour les amis de la poésie, on parle d’effet siphon, ou d’effet lavabo.
La difficulté, avec ce traitement d’apparence séduisante, c’est l’approvisionnement en émulsion lipidique : pas toujours facile de s'en procurer, surtout si on en a besoin en urgence, à dix heures du soir.
Donc, pas facile de traiter ce type d’intoxication chez ce type de chien. C’est un lieu commun, mais dans ce cas plus encore que dans d’autres, mieux vaudra prévenir que guérir.
ALORS, EN PRÉVENTION ?
Deux principaux intérêts :
1 – Si un jour, on a besoin d’utiliser, un tant soit peu en urgence, l’un des médicaments de la liste, (et il y en a beaucoup), eh bien on se retrouvera coincé si l’on ne connaît pas le statut du chien vis à vis du gène MDR1. Alors il y a certains médicaments dont on peut essayer de se passer, mais si l’on a une grosse réaction allergique, un problème cardiaque, un lymphome d’évolution rapide, une gastro avec des vomissements qu’il faut absolument stopper… eh bien soit on utilise respectivement un corticoïde, de la digoxine, de la vincristine, ou une association métoclopramide-oméprazole, mais avec le risque que le chien fasse une réaction potentiellement fatale… soit on essaye de se passer des médicaments précités, mais ce n’est pas toujours facile.
2 – Si vous savez que votre chien est homozygote muté -/-, vous pouvez en avertir tout le monde : mettre un gros sticker jaune sur son carnet de vaccination, le rappeler à votre vétérinaire à chaque consultation ou achat de médicament, etc. Cela pourra éviter qu’un antiparasitaire inadapté (ou tout autre médicament courant comme un tranquillisant avant un trajet en voiture, un anti-vomitif lors d'une "petite" gastro…), ne soit délivré à votre animal par inadvertance.
Cliquez ici pour joindre un vétérinaire qui pourra vous conseiller
RÉFÉRENCES :
- GEYER J, JANKO Ch : Treatment of MDR1 mutant dogs with macrocyclic lactones. Curr Pharm Biotechnol 2012, 13(6) : 969-986.
- GRAMER I & Coll : Breed distribution of the nt230(del4) MDR1 mutation in dogs. Vet J 2011, 189(1) : 67-71.
- HUGNET C & Coll. Toxicité de l’ivermectine chez le chien : conduite à tenir. Pratique Vét 2012, 46 : 666-668.
- MEROLA VM, EUBIG PA : Toxicology of avermectins and mylbemycins (macrocyclic lactones) and the rôle of P-glycoprotein in dogs and cats. Vet Clin North Am Small AnimPract. 2012, 42(2) 313-333.
- MULLER, GUAGUÈRE E : Particularités thérapeutiques raciales. XXVIIèmes journées annuelles du GEDAC : Dermatologie raciale. pp 20-24.
Et les sites Antagène : http://www.antagene.com/fr/aucune/sensibilite-medicamenteuse-mdr1
et Collie online : http://www.collie-online.com/colley/mdr1/index.php